Визначення загальної карбонатної та постійної жорсткості води. Жорсткість води
Жорсткість води
Жорсткість води обумовлена присутністю у ній розчинених солей кальцію та магнію. Якщо у воді розчинені гідрокарбонати цих металів Са(НСО 3) 2 і Mg(HCO 3) 2 то жорсткість називається карбонатною або тимчасовою. Інші солі кальцію та магнію (хлориди, сульфати, силікати та ін.) викликають некарбонатну або постійну жорсткість води.
Використання Вода, що підлягає обробці, проходить вниз за течією через шар іонообмінної смоли, доки її обмінна здатність не буде вичерпана. Коли це станеться, смола може бути регенерована для подальшого обміну. Накладні витрати Потік води змінюється та переміщується вгору через смолу. Цей процес видаляє накопичений матеріал суспензії та зламані гранули смоли, а також вивільняє або розповсюджує смолу, щоб забезпечити гарний розподіл на більш пізніх стадіях. Введення регенератора.
Розведений хімічний агент вводиться в потік нижче потоку через смолу, видаляючи замінені іони, які потім вивантажуються. Це відновлює здатність до торгівлі. Зміщення Поточна вода тече через смолу за низької швидкості потоку, витісняючи хімічний агент регенерації. Прання Швидкий потік води видаляє всі сліди хімічного агента з регенерації.
Загальна жорсткість води дорівнює сумі карбонатної та некарбонатної жорсткостей. Величина жорсткості води (Ж) виражається сумою міліеквівалентів іонів кальцію Са 2+ і магнію Mg 2+ , що містяться в 1 літрі води
(Мл-екв./л). Один міліеквівалент жорсткості відповідає вмісту у літрі води 20,04 мг іонів кальцію або 12,16 мг іонів магнію.
приклад 1.Визначити жорсткість води, якщо відомо, що 1 м 3 міститься 170 г CaSO 4 і 90 г MgSO 4 .
Коли кислоти, що утворюються в катіонному ланці, реагують із лужністю у сирій воді, утворюється діоксид вуглецю. Це можна видалити іонним обміном чи фізично шляхом дегазації. Вибір процесу, зрозуміло, обумовлений чинниками витрат. Більшість іонообмінників є складними системами, які можуть бути зруйновані. Для визначення недоліків іонного обміну важливими є точні записи операцій. Особливу увагу слід приділити наступним областям: Потоки Оброблені обсяги регенерації, нормальні потоки, пікові потоки.
Поповнення тиску, очищена вода між одиницями системи з декількома шарами. Показання мають бути зіставлені з температурою та потоком. Тип смоли, глибина шару, дата установки, результати будь-яких попередніх аналізів смоли. Частота регенерації, кількість концентрованого хімічного агента, час введення, концентрація смоли, швидкість потоку хімічного агента і вода, що розбавляє, потік і тривалість промивання, повільний потік і тривалість промивання, швидкий потік і тривалість промивання.
Рішення.Відповідно до завдання в одному літрі води (1 м 3 = 1000 л) міститься г CaSO 4 і г MgSO 4 . Молярні маси еквівалентів М ек кожної сполуки дорівнюють половині їх молярних мас:
![]() = 68 г/моль;
= 68 г/моль;
![]() = 60 г/моль.
= 60 г/моль.
Аналіз води сирої води, обробленої води, тріщин з кількома шарами. Критерії проектування Визначте умови роботи та найбільш підходящу конструкцію для системи з урахуванням найбільш відповідної системи іонного обміну сирої води. Вода у пивоварній промисловості Вода становить у середньому близько 90% складу пива. Тільки цей факт демонструє важливість якості води для одержання пива з якостями. Це не означає, що вода повинна надходити з артезіанських колодязів або природних гірських джерел, як стверджують багато експертів «пива», а скоріше питання щодо якості та складу солоної води.
Тоді в одному літрі води міститься ![]() молярної маси еквівалента CaSO 4 або 2,5 мл-екв. (стільки ж, тобто 2,5 мл-екв. Са 2+) та
молярної маси еквівалента CaSO 4 або 2,5 мл-екв. (стільки ж, тобто 2,5 мл-екв. Са 2+) та ![]() або 1,5 мл-екв. MgSO 4 (1,5 мл-екв. Mg 2+). Отже, жорсткість води
або 1,5 мл-екв. MgSO 4 (1,5 мл-екв. Mg 2+). Отже, жорсткість води
Ж = 2,5 мл-екв./л CaSO 4 + 1,5 мл-екв./л MgSO 4 = 4 мл-екв.
При правильних хімічних та фізико-хімічних процесах ми можемо буквально перетворити будь-який тип води на невичерпне джерело якості. Ця якість води, чи то за своїм хімічним складом чи фізико-хімічними та мікробіологічними властивостями, стає необхідною для виробництва хорошої якостіпива.
Технологічні вимоги до питній воді. Пивоварна вода повинна спочатку відповідати вимогам до вмісту як фізико-хімічного, так і мікробіологічного складу. Що стосується його фізико-хімічного складу, він повинен підтримувати таку композицію, яка не має корозійних властивостей і має вміст твердих речовин, що відповідає технологічним параметрам походження цих іонів, тобто стехіометрично пов'язано з аніонами мінеральних кислот, що походять з вуглекислоти.
Це завдання можна вирішити, застосовуючи формулу
Мл-екв./л (1)
де m - маса речовини, що викликає жорсткість або застосовується для усунення жорсткості води, мг; М ек – молярна маса еквівалента цієї речовини, г/моль ( ![]() , Z - еквівалентне число); V – обсяг води, л.
, Z - еквівалентне число); V – обсяг води, л.
Іони з карбонової кислоти Карбонова кислота з'являється майже у всіх водах, її асоціація зазвичай відбувається у вигляді карбонатів та бікарбонатів кальцію та магнію. Рідше карбонова кислота може бути пов'язана з натрієм, утворюючи карбонати цього іона. Крім того, вуглекислота все ще може бути у вільній формі, що є необхідною умовою для підтримки рівноваги карбонату, як показано в наведеній нижче реакції.
За наявності кількості, що перевищує кількість, необхідне підтримки цього балансу, цей вільний діоксид вуглецю набуває корозійного характеру на промислових установках. З цим ми можемо класифікувати 4 форми, які у вуглекислому газі.
За величиною загальної жорсткості (мл-екв./л) природні води можна умовно розділити на групи: дуже м'які (Ж<1,5); мягкие (1,5≤Ж≤3,0); средней жесткости (3,0<Ж<5,5); жесткие (5,5≤Ж≤10,7); очень жесткие (Ж>10,7).
приклад 2.Обчислити карбонатну жорсткість води, що містить гідрокарбонат кальцію, якщо титрування 100 см 3 цієї води витрачено 6,25 мл 3 0,08 н розчину HCl.
Комбінована вуглекислота. Кількість діоксиду вуглецю, стехіометрично пов'язаного у вигляді карбонатів та бікарбонатів. Вільна вуглекислота є кількістю вуглекислого газу, розчинного у воді, не пов'язаного з карбонатними та бікарбонатними солями. Балансування вуглекислоти. Кількість діоксиду вуглецю, що присутня в реакції оборотного бікарбонату, яка зберігає свою розчинність. Агресивна карбонова кислота. Кількість вуглекислого газу, що у реакції оборотного бікарбонату перевищує його розчинність.
Рішення.Визначення карбонатної жорсткості води засноване на реакції взаємодії соляної кислоти з гідрокарбонатами кальцію та магнію (в даному випадку лише гідрокарбонату кальцію):
Са(НСО 3) 2 + 2HCl = CaCl 2 + 2CO 2 + 2 H 2 O.
Відповідно до закону еквівалентів обсяги розчинів реагуючих речовин обернено пропорційні їх нормальним концентраціям С ек:
Знаючи частини відбуваються утворює вуглекислоту має життєво важливе значення для запобігання забруднення та корозією проблем у всіх промислових об'єктах, а також знати зворотну тенденцію забруднення та корозії пивоварної води. Іони кальцію та магнію з вуглекислоти надають негативний вплив на ідеальний рН колби, тому що вони реагують з фосфатом калію, підвищуючи рН вище ідеального.
Як видно з реакцій сусла фосфатів бікарбонатів, що дія бікарбонату магнію є ще більш шкідливим, ніж бікарбонат кальцію, магній у вигляді фосфат є лужно-розчинним, у той час як фосфат кальцію, незважаючи на те, що луг нерозчинний, таким чином, потрапляючи в мішечок.
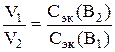 , (2)
, (2)
де V 1 - обсяг першого розчину з концентрацією С ек (В 1); V 2 - обсяг другого розчину з концентрацією С ек В 1 .
За умовою завдання молярна концентрація еквівалентів (нормальність) гідрокарбонату кальцію не відома. Знаходимо нормальність розчину гідрокарбонату кальцію із формули (2).
Іони, отримані з мінеральних кислот, іони, пов'язані з мінеральними кислотами, замість того, щоб надавати дію підкисляючого повинні вступати в реакцію з лужної фосфати сусло утворюючи відповідні аніони кислот, а саме. Як ми вже бачили, бікарбонати надають негативну дію на рН сусла, яку ми могли б назвати «підлугові», тоді як солі мінеральних кислот, надають позитивну дію або «кислота». Для коригувальних дій ми повинні помістити ці дві дії в масштабі та визначити через залишкову лужність води тенденції цієї води при отриманні сусла.
Знаючи нормальність розчину, визначаємо число міліеквівалентів гідрокарбонату кальцію: 0,005∙1000 = 5 мл-екв. Таким чином, 1 л досліджуваної води міститься 5 мл-екв. гідрокарбонату кальцію або іонів Са2+. Отже, карбонатна жорсткість води, що досліджується, - 5 мл-екв./л.
Зменшення вмісту іонів кальцію та магнію у воді називається пом'якшенням. Воно може бути здійснено переведенням цих іонів у важкорозчинні з'єднання методом іонного обміну та перегонкою води. При пом'якшенні води методом осадження іони кальцію та магнію зазвичай переводять у карбонат кальцію, гідроксид магнію або тризаміщені фосфати.
Тоді ми б визначити залишкову лужність води як протистояння цих двох впливів іонів, присутніх у питній воді, тобто. Для легкого пива часто використовують воду з негативною залишковою лужністю, додаючи хлорид кальцію або сульфат. Ідеальним у разі було б змішання цих двох солей.
Залишкова лужність питної води є головною особливістю, яку ми маємо враховувати. Впливи декількох іонів, присутніх у воді. Інгібує утворення барвників під час струминної обробки та просочення поліфенолів під час вилуговування. Забезпечує субстрат для коагуляції білків. Він захищає альфа-амілазу від денатурації, спричиненої теплом під час вибуху. Він тримає в облозі оксалати, присутні в колбі, тим самим уникаючи небезпеки утворення Гушинга. Надає неприємну гіркоту.
Приклад 3. Скільки грамів соди Na 2 CO 3 потрібно додати до 100 л води, щоб усунути жорсткість 4 мл-екв./л?
Рішення. За умовою завдання у 100 л води міститься 100×4 = 400 мл-екв. солей, що викликають твердість води. Для усунення цієї жорсткості згідно із законом еквівалентів необхідно додати таку ж кількість речовини, що пом'якшує воду, в даному випадку – соду Na 2 CO 3 . Розрахуємо масу 400 міліеквівалентів карбонату натрію:
Підкислювальна дія становить половину іонів кальцію. У невеликих кількостях необхідно стимулювати певні солодові ферменти і служити кофактором для різних ферментів під час ферментації. Він виконує фізіологічну функцію в дріжджовій клітині. У великій кількості він інгібує дію кількох ферментів під час формування. Забезпечує клітинне розмноження дріжджів у формі, що подає. Він забезпечує кращу концентрацію піни та сприяє синтезу деяких ферментів дихального метаболізму дріжджових клітин.
21200 мг = 21,2г.
Таким чином, для усунення жорсткості до 100 л води необхідно додати 21,2 г Na 2 CO 3 .
Це завдання можна вирішити, використовуючи формулу (1).
Лабораторна робота
Жорсткість води
Досвід 1. Визначення карбонатної (тимчасової) жорсткості води
Лабораторне визначення карбонатної жорсткості ґрунтується на реакціях взаємодії соляної кислоти з гідрокарбонатами (див. приклад 2). Пробу води титрують 0,1 н розчином соляної кислоти у присутності 2-3 крапель індикатора метилового оранжевого. У точці еквівалентності при незначному надлишку кислоти індикатор змінює своє забарвлення з жовтою на рожеву.
Це заважає сахарифікації сутності. Темні та пиво. Швидке старіння пива шляхом окислення поліфенолів та наявність барвників утворюють небажані карбоніли. Вони можуть викликати каламутність у пиві. Викликає збільшення гіркоти пива, але гіркоту як терпкість.
Як можна проаналізувати питання води є досить складним, вплив якості води на пива, але з технологією доступна сьогодні, домашній пивовар має всі шанси отримання хорошого пива. Такі теми, як "пиво в такому місці добре через воду" є міфом і такі теми, як "пиво, зварене з кристально чистою водою гори, або гори" це величезна дурість, головним чином тому, що поверхня води з гір перетягнути все фекалії справжньої фауни.
Виконання досвіду
У 3 колби ємністю 200 мл налити по 100 мл води та додати по 3 краплі індикатора метилового оранжевого. У першу колбу вливати по краплях з бюретки розчин соляної кислоти 0,1 н концентрації доти, доки вода в колбі від чергової краплі не змінить жовте забарвлення на рожеве. Відзначити обсяг витраченої кислоти з точністю до 0,1 мл. Те ж саме зробити з другою та третьою колбами. Розрахувати середній обсяг кислоти, витрачений на титрування. Визначити карбонатну твердість води.
Це вода, яка робить пиво? Просто зануріть стрічку у воду, яку потрібно перевірити та прочитати. Читання результатів може бути виконано за допомогою програми на мобільному телефоні або шляхом ручного порівняння. Результати для рівнів хлору, нітрату, нітриту, загальної твердості, лужності та рН.
Значення від 5 до 5 ідеальне. Висока цінність шкідлива для корисних бактерій та риби. Тест занурення для перевірки 6 різних показників якості води лише за 60 секунд! Загалом вуглекислого газу існує різниця між: - вільним розчиненим діоксидом вуглецю або вільним діоксидом вуглецю - двоокисом двоокису бікарбонату або іонами карбонату натрію - двоокисом вуглецю карбонатних іонів.
1. Знайти молярну концентрацію еквівалентів С ек розчину гідрокарбонатів за формулою (2) (див. приклад 2).
2. Обчислити карбонатну жорсткість води.
Ж к = С ек ∙ 1000 мл-екв./л іонів Са 2+ та Mg 2+ .
Написати молекулярні та іонно-молекулярні рівняння реакцій, що протікають при титруванні.
ЛАБОРАТОРНА РОБОТА №6
Ця кількість-вуглецева рівновага істотно залежить від рН, лужності та температури води. Розчинення вапняку відбувається до досягнення рівноваги. Як правило, поверхневі води не містять понад 10 мг. Деякі мінеральні води мають значення, що перевищують 100 мг. Опір води відповідає присутності гідроксильних іонів, 2-карбонати та бікарбонати та, меншою мірою, до іонів 3-фосфату та силікату або до молекулярних видів слабких кислот. Тісно пов'язана з твердістю, його значення, як правило, близько, коли воно обумовлено наявністю карбонатів та бікарбонатів.
Жорсткість води.
Мета роботи:методом комплексонометрії визначити загальну жорсткість води; методом нейтралізації визначити карбонатну, тимчасову та постійну жорсткість.
Жорсткість води обумовлена наявністю у ній розчинних солей кальцію, магнію. Жорсткістю називається кількість мг-еквіонів Са 2+ , Mg 2+ , що містяться в 1л води. 1 мг-екв (російський градус жорсткості) відповідає 40,08/2=20,04 мг/л Са 2+ або 24,3/2=12,15 мг/л Mg 2+ .
У природних водах лужність, що у бікарбонатах, коливається від 10 до 350 мг. Він доповнюється матеріалами міського чи промислового походження. Алкаліметричний титр та повний алкалітичний титр відображають лужність води. Знання цих значень має значення для вивчення згоди води. Вони залежать від кількох-вуглецевої рівноваги. Загальна жорсткість або гідротиметрова назва. Тартар у трубах: чим більше води містить іон кальцію, тим більше може бути важливе вапнякове родовище.
Зміст іонів кальцію та магнію характеризується гідротиметричним титром. Щоб запобігти осадженню окалини в трубах, воно пом'якшується твердою водою в пом'якшувачі. Спочатку твердість виражала здатність води реагувати з милом. Твердість по суті відповідає присутності солі кальцію та магнію. Це безпосередньо пов'язане з геологічним характером земель, що перетинаються. Таким чином, вапняний або дрібний ґрунт дасть тверду воду, а вода, що перетинає кристалічний ґрунт, як пісок, дасть м'яку воду.
Розрізняють загальну, карбонатну, тимчасову та постійну та некарбонатну жорсткість.
Загальною жорсткістюназивається сумарна концентрація іонів Са 2+, Mg 2+ чи солей кальцію, магнію.
Тимчасовою жорсткістюназивається частина загальної жорсткості, що віддаляється кип'ятінням води при атмосферному тиску Вона дорівнює різниці між загальною та постійною жорсткістю. Обумовлена наявністю у воді гідрокарбонатів калію та магнію, які при кип'ятінні розкладаються:
Ca(HCO 3) 2 = CaС0 3 + СО 2 + Н 2 O
Mg(HCO 3) 2 = Mg(OH) 2 + 2СО 2
Постійною жорсткістюназивається частина загальної твердості, що залишається після кип'ятіння води при атмосферному тиску. Вона обумовлена наявністю кальцієвих та магнієвих солей сірчаної, соляної, азотної, фосфорної та кремнієвої кислот, які при кип'ятінні води залишаються у розчині.
Карбонатною твердістюназивається частина загальної жорсткості, еквівалентна концентрації карбонатів та гідрокарбонатів кальцію та магнію.
Некарбонатною твердістюназивається частина загальної жорсткості, вона дорівнює різниці між загальною та карбонатною жорсткістю.
За твердістю воду поділяють на: дуже м'яку (0-1,5 мг-екв/л солей), м'яку (1,5-3), середньої жорсткості (6-10) і дуже тверду (понад 10).
За ГОСТ 1974-82 допустима жорсткість води для господарсько-питного водопостачання має становити трохи більше 7мг-экв/л. Солі, що обумовлюють жорсткість води, не є шкідливими для живих організмів, проте наявність їх у воді у великій кількості небажана, оскільки вода стає непридатною для господарсько-побутових потреб.
Процес, що призводить до зниження жорсткості води, називається пом'якшенням. Пом'якшення зводиться до зменшення концентрації солей кальцію та магнію. Існуючі способи пом'якшення води можна розділити на три групи: реагентні методи: содово-вапняний, лугом, солями барію, фосфатами; метод іонного обміну з використанням іонітів; Термічний метод.
Визначають жорсткість об'ємним методом - комплексонометричним та нейтралізації.
Визначення загальної та тимчасової жорсткості води комплексонометричнимметодом.
Це найбільш точний і поширений метод визначення загальної жорсткості, заснований на утворенні іонами Са 2+ і Mg 2+ міцних внутрішньокомплексних сполук з двонатрієвою сіллю етилендіамінтетраоцтової кислоти Na 2 Н 2 Еdta або трилоном Б:
При титруванні води трилоном Б відбувається зв'язування іонів кальцію і магнію, а розчин йдуть іони водню, що призводить до збільшення кислотності води. Нагромадження іонів водню вище певних значень, може викликати руйнування комплексу, що утворився, тому титрування ведуть при рН=8-10. Таке значення рН досягається за допомогою буферного аміачного розчину. Точка еквівалентності визначається за допомогою метал-індикаторів Н2Ind: мурексид. кислотний хромоген чорний та інші, які утворюють з іонами кальцію та магнію менш стійкі комплекси, ніж внутрішньокомплексні сполуки трилону Б, що руйнуються у процесі титрування. Тому в точці еквівалентності малиново-червоне забарвлення розчину переходить у синє, обумовлене забарвленням аніону індикатора Ind:
Н 2 Ind = 2Н + + Ind 2- Малиново-червоний синій
Са 2+ + Ind 2- = Са Ind
Вишнево-червоний (рН = 8-10)
СаInd + Na 2 Н 2 Еdta = СаNa 2 Еdta + 2Н + + Ind 2-
Безбарвний синій
Досвід 1. Визначення загальної жорсткості
Хід визначення.У конічну колбу на 250мл піпеткою відібрати 100мл досліджуваної води, додати 5мл аміачної буферної суміші та на кінчику лопатки (кілька крупинок) індикатора. Забарвлений розчин титрувати робочим розчином трилону Б до переходу вишнево-червоного забарвлення в синю. Увага! Забарвлення розчину від надлишку трилону Б залишається незмінним, у кінці титрування робочий розчин трилону Б слід додавати по краплях. Записати результати титрування.
Розрахунок.Загальну жорсткість води розрахувати за формулою (1), використовуючи закон еквівалентів для розчинів:
Сн(тр.Б) · V(тр.Б)
Жоб = · 1000, (1)
де Жоб – загальна жорсткість води, мг-екв/л; Сн(тр.Б.) - нормальність трилону Б, моль/л; У(тр.Б) - обсяг трилону Б, що пішов на титрування, мл; V(H 2 O) – обсяг проби води, мл.
Досвід 2.Визначення тимчасової та постійної жорсткості.
Хід визначення.У конічну колбу на 250мл піпеткою відміряти 100мл досліджуваної води. Олівцем по склу відзначити рівень води у колбі. Закрити колбу вирвою і кип'ятити 1 годину. При кип'ятінні утворюється осад. У міру випаровування води в колбі обережно доливати дистильовану воду до мітки. Після охолодження профільтрувати кип'ячену воду через сухий фільтр в чисту суху колбу, 2-3 рази промити фільтр невеликою кількістю води, що дистилює (промивання води з'єднати з профільтрованою пробою). Подальше визначення постійної жорсткості (Жпост) та розрахунок вести як у досвіді 1.1.
Розрахунок тимчасової твердості. Тимчасова жорсткість визначається за різницею між загальною та постійною жорсткістю.
Жвр = Жоб. - Жпост.
Визначення карбонатної твердості методом нейтралізації.
В основі методу лежить реакція нейтралізації – взаємодії між кислотою та лугом. Точку еквівалентності визначають, використовуючи кислотно-основні індикатори.
Досвід 3. Визначення карбонатної твердості
Метод заснований на зв'язуванні іонів НСО 3 - та СО 3 2 - кислотою в присутності метилоранжу. При титруванні протікають реакції:
3 2- + НСО 3 - ; НСО 3 - + Н + = CO 2 + H 2 O
Хід визначення.У конічну колбу на 250мл піпеткою відміряти 100мл досліджуваної води, долити 2 краплі метилоранжу. Відтитрувати пробу 0,1 н робочим розчином соляної кислоти до переходу жовтого забарвлення помаранчеву. Записати результати титрування.
Розрахунок.Карбонатну жорсткість води розрахувати за формулою (2), використовуючи закон еквівалентів для розчинів:
Сн(НСl) · V(HC1)
Рк = 1000 , (2)
де Жк – карбонатна жорсткість, мг-екв/л; Сн(НС1) – нормальність робочого розчину соляної кислоти, мл; V(HC1) - обсяг соляної кислоти, що пішов на титрування, мл; V(H 2 O) – обсяг проби води, мл.
Висновок:
Питання та завдання.
1. Що називається жорсткістю? Вкажіть одиниці виміру жорсткості. Перерахуйте класи твердості, види твердості.
2. Як кількісно визначають жорсткість води? Охарактеризуйте зги методи, запишіть рівняння реакцій.
3. Охарактеризуйте способи пом'якшення води. Запишіть рівняння реакцій.
4. Що таке іонообмінні смоли: катіоніти, аніоніти? Наведіть приклади. Дайте поняття та розрахунок обмінної ємності. Що таке ренегація іонітів. Які переваги має метод іонного обміну перед реагентними методами?
5. Що таке імпфірування? Галузь застосування. Перевага та нестача методу.
7. Скільки 3% розчину HCI знадобиться, щоб карбонатну жорсткість (8 мг-екв/л) 4 м 3 води, що використовується в теплообміннику, перевести в некарбонатну?
8. Яку масу фосфату натрію треба додати до 500 л води, щоб усунути її карбонатну жорсткість, що дорівнює 5мт-екв/л.
9. Аналізом води знайдено: некарбонатні жорсткість дорівнює 3,0 мг-екв/л; карбонатна жорсткість – 4,5 мг-екв/л; магнієва жорсткість 2,4 мг-екв/л; вільної CO2 - 8 мг-екв/л. Розрахувати дозу вапна (у перерахунку на СаО) та дозу безводної соди.
10. Визначити кількість іонів кальцію, що поглинається I л катіоніту, якщо його робоча ємність становить 730 г-екв/м 3 .




